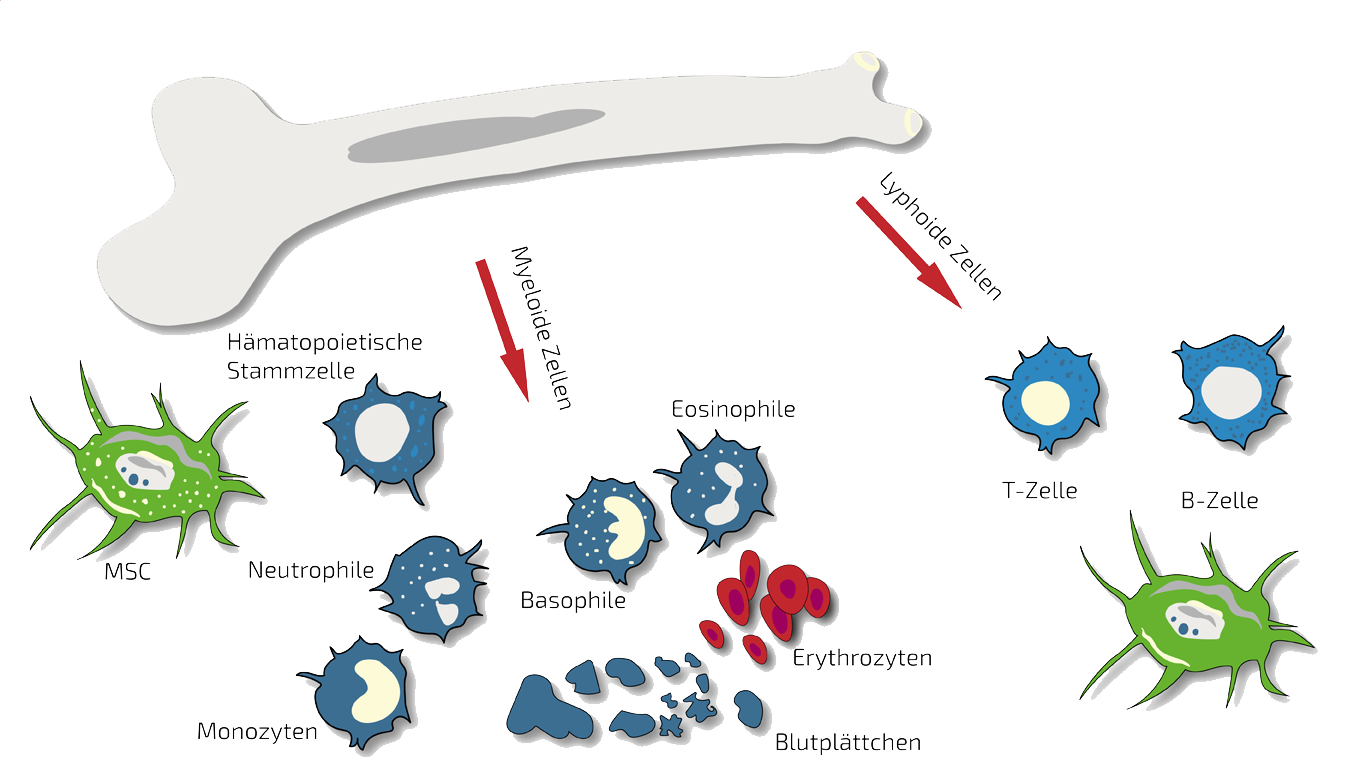
Behandlung von Harninkontinenz mit Stammzellen und Stammzellsekretom
Harninkontinenz ist der ungewollte Verlust von Urin. Stressinkontinenz tritt auf, wenn körperliche Bewegungen oder Aktivitäten - wie Husten, Lachen, Niesen, Laufen oder schweres Heben - Druck (Stress) auf die Blase ausüben, wodurch Urin austritt.
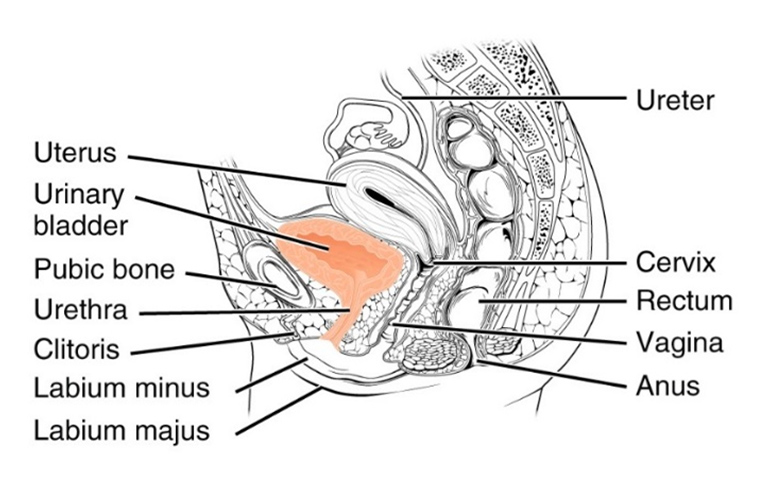
Bei Frauen sind Schwangerschaft, Geburt, Übergewicht und Wechseljahre die häufigsten Ursachen für Stressinkontinenz, die auf einen unzureichenden Verschluss des Harnröhrenschließmuskels aufgrund einer Schwäche des Beckenbodens oder einer direkten Schädigung des Schließmuskels zurückzuführen ist II,III,IV.
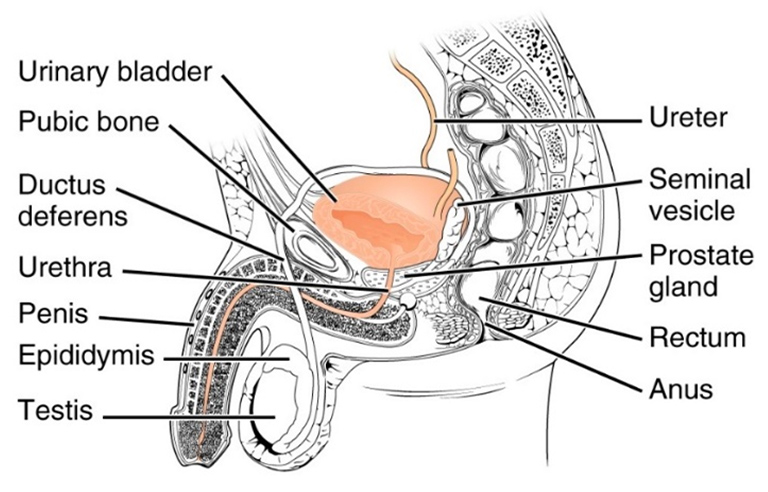
Bei Männern tritt Stressinkontinenz am häufigsten nach ProstataoperationenI auf, z. B. nach einer Prostatektomie bei Krebs oder nach einer transurethralen Resektion der Prostata (TURP) bei einer gutartigen Vergrößerung der Prostata, der benignen Prostatahypertrophie (BPH).
Standardtherapien zur Behandlung der Harninkontinenz bieten häufig nur eine symptomatische Linderung, ohne die zugrunde liegende Ursache der Erkrankung zu bekämpfen.
In jüngster Zeit hat sich die Verwendung von Stammzellen, die das Fortschreiten der Krankheit aufhalten und die zugrunde liegende Pathologie rückgängig machen sollen, als vielversprechende Methode zur Wiederherstellung der normalen Miktionsfunktion erwiesen.
ANOVA IRM - Pioniere der Stammzelltherapie bei Harninkontinenz
Im ANOVA Institut für Regenerative Medizin prüft unser interdisziplinäres Expertenteam mit einer umfassenden Diagnostik Ihre Inkontinenzprobleme und Ihre Eignung für eine Stammzellbehandlung.
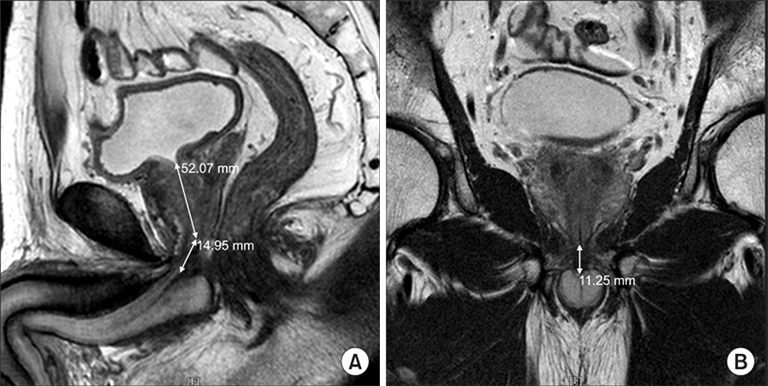
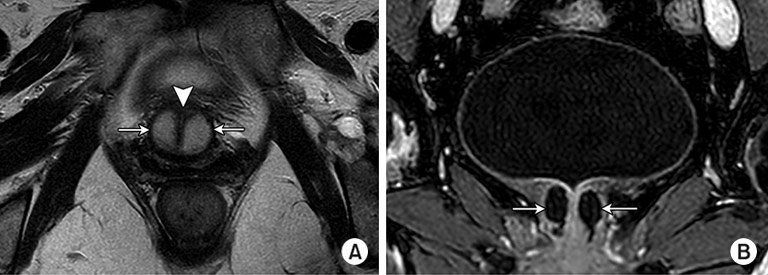
Gemeinsam mit dem Prof. Stehling Institut für Bildgebende Diagnostik haben wir spezielle bildgebende Verfahren entwickelt, um die kritischen anatomischen Strukturen am Beckenboden sichtbar zu machen, darunter die dynamische Darstellung des Beckenbodens unter Belastung und die hochauflösende Darstellung des Harnröhrenschließmuskels.
Dadurch können wir die Behandlung mit Stammzellprodukten genau auf den Bereich ausrichten, in dem die Stammzellen am meisten benötigt werden. Mit dem Stammzellsekretom können wir den Harnschließmuskel perfundieren, um seine Funktion zu reaktivieren, ohne die empfindliche anatomische Struktur des Schließmuskels zu beschädigen. Dies ist einer der vielen Vorteile gegenüber chirurgischen Eingriffen, die unweigerlich zu einer teilweisen oder vollständigen Zerstörung des Schließmuskels führen.
Stammzellentherapien bei Inkontinenz
ANOVA Institute for Regenerative Medicine - Offenbach, Deutschland
Secretome/Exosomen
Potenzhypothese der Stammzellentherapien
Stammzellen besitzen das Potenzial, mit den Immunzellen zu kommunizieren, die die Entzündung hervorrufen, und können auf natürliche, bisher nicht verstandene Weise eine immunüberreaktion hemmen. Darüber hinaus haben Stammzellen die Fähigkeit, die Regeneration von Gewebe zu stimulieren und somit dem Funktionsverlust entgegenzuwirken.
In den letzten Jahren hat sich besonders im urologischen Bereich eine besondere Begeisterung für stammzellbasierte Therapien entwickelt, insbesondere für die Behandlung der Inkontinenz. Mehrere präklinische Studien haben die Anwendung von Stammzellen für urologische Erkrankungen erforscht, insbesondere Knochenmarkstammzellen (BMSC) und aus Fett gewonnene Stammzellen (ADSC) zur Behandlung von Inkontinenz in Tiermodellen, wie von Soebadi et al. 2016 zusammengefasst.
Bei akuter Inkontinenz wird angenommen, dass der Reparaturmechanismus, den Stammzellen bewirken, auf parakriner Ebene liegt. Bei chronischer Inkontinenz basiert die Wirkung von Stammzellen jedoch möglicherweise hauptsächlich auf Engraftment und zellulärer Differenzierung. Der genaue Mechanismus, wie Stammzellen die Funktion bei chronischer Inkontinenz verbessern, ist noch nicht vollständig gelöst.
MSEC - Mesenchymale Stammzell-Secretome - Exosomen - Autolog
Patienten mit einer langen Vorgeschichte von Inkontinenz-Symptomen werden in der Regel mit MSEC (Secretome, Exosomen, EVs) von mesenchymalen Stammzellen (MSC, AD-MSC, aus Fett gewonnene Stammzellen) behandelt, die wir dem Bauch der Patienten bei einer Mini-Fettabsaugung (sehr kurze und begrenzte Fettabsaugung) unter leichter Sedierung entnehmen. Weltweit ist ANOVA die erste Stammzellklinik, die die rechtliche Genehmigung der zuständigen staatlichen Behörden erhalten hat und somit hochwertige, sichere und rechtlich kontrollierte autologe (eigene) Exosom-enthaltende Secretome anbietet.
Der Hauptvorteil von MSEC besteht darin, dass im Gegensatz zu lebenden Stammzellen, die ihre therapeutische Potenz verlieren würden, Exosomen ohne Verlust eingefroren werden können. Dies ermöglicht uns die Herstellung von 10-20 Injektionsdosen aus einer Fettabsaugung, die dann über einen längeren Behandlungszeitraum verabreicht werden können. Dies ist besonders vorteilhaft für die langfristige Stimulation der Regeneration bei Inkontinenz.
Was ein Secretome/Exosom ist und wie sie sich vergleichen, wird auf unserer Übersichtsseite erläutert.
BMC - Knochenmark-Stammzellen
In der Regel ist BMC unser Therapeutikum der Wahl bei Harninkontinenz-Problemen mit verschiedenen Ursachen. Da hier oft eine auf ein bestimmtes Gebiet beschränkte Erkrankung gegeben ist, behandeln wir an oder in der Nähe der betroffenen Stelle. BMC enthält eine natürliche Mischung sogenannter autologer (körpereigener) Stammzellen. Diese entnehmen wir in einer schnellen und unkomplizierten Knochenmarkpunktion aus Ihrem Beckenkamm.
Diese Stammzellen sollen die Entzündung schnell eindämmen und so Ihre Beschwerden lindern sowie die Regeneration fördern. Für eine mehrfache Behandlung kombinieren wir BMC-Gaben oft mit PRP oder Hyaluronsäure (s.u.). Mehr über diesen Typ Stammzellen finden Sie hier: BMC. Für weiterführende Informationen über unsere Stammzellen-basierten Behandlungen bei Harninkontinenz kontaktieren Sie uns jederzeit.
Kontraindikationen
Unsere Stammzellbehandlungen sind experimentell, aber wir behandeln nur solche Patienten, von denen wir auf Grundlage des Standes der Medizin, also der medizinisch-wissenschaftlichen Evidenz davon ausgehen, dass das Risiko/Nutzen-Verhältnis eine Behandlung indiziert.
Bitte haben sie Verständnis dafür, dass wir daher keine Patienten behandeln auf die folgende Punkte zutreffen:
- Aktive Krebserkrankung in den letzten zwei Jahren
- Noch nicht volljährig
- Bestehende Schwangerschaft oder Stillzeit
- Nicht in der Lage, selbständig zu atmen, bzw. Verwendung eines Beatmungsgeräts
- Schwierigkeiten mit der Atmung in Rückenlage
- Dysphagie (extreme Schluckbeschwerden)
- Psychiatrische Erkrankung
- Aktive Infektionskrankheit (Hepatitis A, B, C, HIV, Syphilis etc.)
Wie Stammzellen und ihr Sekretom Harninkontinenz behandeln können
Klassischerweise geht man davon aus, dass Stammzellen beschädigte Gewebe und Organe reparieren, indem sie sich in beschädigte Zellen differenzieren und diese ersetzen. In den meisten Fällen üben Stammzellen ihre therapeutische Wirkung jedoch durch die Sekretion bioaktiver Moleküle und Mikrovesikel aus, die zusammenfassend als "Stammzellsekretom" bezeichnet werden. Es ist das Sekretom, das andere Stamm- und Vorläuferzellen, die bereits im Gewebe oder Organ vorhanden sind, an den Ort der Verletzung lenkt. Das Sekretom hat auch antiapoptotische und entzündungshemmende Eigenschaften, reduziert die Narbenbildung, bewirkt eine Neovaskularisierung und hat immunmodulatorische Eigenschaften.
Lokale Injektionen von mesenchymalen, muskulären und fetthaltigen Stammzellen haben in Tiermodellen mit mechanischen, nervalen oder äußeren Verletzungen des Harnröhrenschließmuskels bei Belastungsharninkontinenz zu erfolgreichen Ergebnissen geführt. Erste klinische Versuche mit Stammzellen zur Behandlung der Belastungsharninkontinenz bei männlichen und weiblichen Patienten haben vielversprechende funktionelle Ergebnisse mit minimalen unerwünschten Wirkungen erbrachtV.
Während die Injektion von Füllstoffen die Harninkontinenz verbessern kann, insbesondere bei Frauen VI (siehe unten), kann die Injektion von Stammzellen in und unmittelbar neben die Harnröhre bessere funktionelle Ergebnisse liefern.
Lange erwartet - jetzt verfügbar für die Behandlung von Harninkontinenz:
ANOVA-Stammzellen und Stammzellsekretom
Während Stammzelltherapien in der urologischen Fachliteratur seit vielen Jahren als vielversprechend und erfolgreich für die Behandlung von Harninkontinenz beschrieben werden, beklagen Urologen die Nichtverfügbarkeit von Stammzellprodukten aufgrund von Zulassungsproblemen. In Deutschland wurde dieses Problem kürzlich auf der Jahrestagung der Deutschen Gesellschaft für Urologie (DGU) , angesprochen VII,VIII.
Das hat sich geändert: seit das ANOVA Institut für Regenerative Medizin die erste Herstellungserlaubnis für mesenchymales Stammzellsekretom und Stammzellen aus dem Knochenmark erhalten hat..
Wenn Sie unter Harninkontinenz leiden, rufen Sie uns an, um einen Termin mit einem unserer medizinischen Experten zu vereinbaren und herauszufinden, ob Stammzellen Ihnen helfen können, wieder ein besseres Leben zu führen.
Referenzen
- Nitti, Victor W (2001). "The Prevalence of Urinary Incontinence". Reviews in Urology. 3 (Suppl 1): S2–S6. ISSN 1523-6161. PMC 1476070. PMID 16985992.
- Subak, Leslee L.; Richter, Holly E.; Hunskaar, Steinar (December 2009). "Obesity and urinary incontinence: epidemiology and clinical research update". The Journal of Urology. 182 (6 Suppl): S2–7. doi:10.1016/j.juro.2009.08.071. ISSN 1527-3792. PMC 2866035. PMID 19846133.
- Rortveit, G.; Hannestad, Y. S.; Daltveit, A. K.; Hunskaar, S. (December 2001). "Age- and type-dependent effects of parity on urinary incontinence: the Norwegian EPINCONT study". Obstetrics and Gynecology. 98 (6): 1004–1010. doi:10.1016/s0029-7844(01)01566-6. ISSN 0029-7844. PMID 11755545. S2CID 20932466.
- Lukacz, Emily S.; Lawrence, Jean M.; Contreras, Richard; Nager, Charles W.; Luber, Karl M. (June 2006). "Parity, mode of delivery, and pelvic floor disorders". Obstetrics and Gynecology. 107 (6): 1253–1260. doi:10.1097/01.AOG.0000218096.54169.34. ISSN 0029-7844. PMID 16738149. S2CID 1399950.
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4294800/
- Macura KJ, Genadry RR, Bluemke DA. MR Imaging of the Female Urethra and Supporting Ligaments in Assessment of Urinary Incontinence: Spectrum of Abnormalities. RadioGraphics 2006; 26:1135–1149.
- Amend B, Stenzl A. Aktuelle Therapiemöglichkeiten für die komplizierte Belastungsharninkonntinenz bei Frauen. Uroforum 2021;9:32-34.
- Klein G, Hart ML, Brichmann A, et al. Mesenchymal stromal cells for sphincter regeneration. Adv Drug Deliv Rev. 2015;82-83:123-136